私は、現在大学教育学部の教員として、将来教師(特別支援学校、または小学校)を目指す学生たちに小児の生理・発達そして障害を引き起こす疾患について教えています。その一方で、小児科専門の医師として病院や相談センターなどで様々な問題を抱えた子どもたちへの診療・相談活動も行っています。また、かつては基礎医学の分野に身を置く研究者として、遺伝子やタンパク、受精卵などを操作して様々な子どもの疾患の発症とその治療に関わる研究も行ってきました。
現在は、主に自閉症スペクトラムなどの患者さんたちや健常な大学生たちを被験者として前頭葉や自律神経、ストレス物質などの変化について調べる実験を行っています。こちらは臨床研究のページでご紹介したいと思います。臨床研究のページへ
基礎研究においてこれまでに私が手がけ、何らかの疾患病態の解明の糸口を作ることが出来た小児の疾患は
と多岐にわたります。
さらに、米国留学中には、胎生期の様々な臓器の発生に関わる因子(GATA-4)に関する研究を行い、様々な疾患(心奇形や脳の発生異常、発達異常、血液疾患など)の発症が、胎生ごく初期の胎児環境に大きく影響されることも学びました。
このような研究活動、そして近年行っている小児の心理外来での経験を通して、私は最近、ヒトの発達や発生を取り巻く環境の重要性について強く意識し、危機感を持つようになりました。
乳幼児突然死症候群(sudden infant death syndrome, 以下SIDS)は、「それまでの健康状態及び既往歴からその死亡が予測できず、しかも死亡状況及び剖検によってもその原因が不詳である、乳幼児に突然の死をもたらした症候群」と定義される乳幼児の疾患ですが、一般に、1歳以下のかわいい盛りの子に多く起こる悲劇です。「寝ていたはずなのに気がついたら息をしていなかった」といったことで発見されることが多く、家族に与える苦しみ、悲しみもまた尋常ではありません。この病気は、1960年代より疾患概念として提唱され始め、現在ではSIDSはただの事故ではなく、共通の原因が存在することは明白とされています。しかし、その原因がなんであるかに関してはいまだにわかっていません。さまざまな仮説の中で、現在最も多く支持されているSIDS患児に共通とされる病態は、「睡眠時の無呼吸からの回復が遅れる覚醒反応の異常」、つまり、SIDS患児における睡眠・呼吸中枢を含む脳幹部のなんらかの異常の存在があるということです。では、これら脳幹部の異常に関連する物質とは何でしょうか。ひとつの有力な候補として、セロトニン神経系の異常が指摘されています。セロトニンニューロンは、脳幹部に広く投射しており、神経伝達物質であるセロトニンを介して睡眠・呼吸を初めとする脳幹の生命維持機構の調節に重要な役割を担っているからです。そこで私たちは、PCR法を用いてSIDSの患児と健常者におけるセロトニントランスポーターというセロトニンの機能に深く関わる遺伝子の多型、つまり「ちょっとした遺伝子の形の違い」の分布を比べて見ることにしました。この形の違いには日本人では3種類あって、S、L、XLと呼ばれます。
 この図に示したように、コントロールに比べて、SIDSの患児群では、L、XLの多型を持つ人の割合が多く、Sの多型を持つ人の割合が少なくなっていました。
この図に示したように、コントロールに比べて、SIDSの患児群では、L、XLの多型を持つ人の割合が多く、Sの多型を持つ人の割合が少なくなっていました。
この発見は、「SIDSに、セロトニンが関わっている」という観点からも、「SIDSに遺伝的に関与している部分もある」という二点において、世界で初めて科学的に証明した、貴重なものでした。発表論文はこちら
実は、この多型は人種間でも割合がずいぶん違うのですが、この違いがSIDSの人種間発生頻度の違いと良く相関していることがわかりました。
| SIDS発生頻度 (人口1000対、1995年度) | 5HTTLPR ( L+XLアリル頻度*) | |
|---|---|---|
| アメリカ黒人 | 1.79(米国CDCデータ) | 75.5% |
| アメリカ白人 | 0.71(米国CDCデータ) | 59.6% |
| 日本人 | 0.44(厚生省人口動態統計) | 16.7% |
つまり、SIDSが比較的発生しやすい人種にはLとかXLといった遺伝子の形が多く存在する、という不思議な一致を見たわけです。実は、SとかLとかという多型は、セロトニントランスポーターの遺伝子の働きの差に関係があるという報告もあります。もしかすると、この遺伝子の多型による働きの差がセロトニンを介した呼吸中枢での働きの差につながり、「SIDSになりやすい個体」を規定しているのかもしれません。2003年には、私たちのこの発見がアメリカでも追試で確認され(American Journal of Medical Genetics 117A:268-274,2003)、さらにセロトニントランスポーター遺伝子の発現をコントロールすることが知られている転写因子Pet-1のノックアウトマウスで、SIDSと全く同じ症状、すなわち生後早期に呼吸障害で死亡する個体が散見され、SIDSの本態にセロトニンが関わっている、という新しい考え方は、今後ますます市民権を得ていくものと思われます。
関連論文
- Narita N, Narita M, Takashima S, Nakayama M, Nagai T, Okado N.
Serotonin transporter gene variation is a risk factor for sudden death syndrome in Japanese population.
Pediatrics, 2001 107:690-692 - Okado N, Narita M, Narita N,
Serotonin malfunction hypothesis by finding clear mutual relationships between several risk factors and symptoms associated with sudden infant death syndrome
Medical Hypothesis, 2002 58:232-236 - 成田奈緒子
乳幼児突然死症候群とセロトニン
クリニカルニューロサイエンス 2003 21(6):698-700 - 成田正明、成田奈緒子
SIDSの新しい危険因子についての検討
日本小児救急医学会雑誌, vol. 1, Number 2, 13-15, 2003 - 成田奈緒子、成田正明、永井敏郎
小児の突然死の原因
日本医事新報 2005; 4235: 90-92.
社会性とコミュニケーションの障害として、幼児期に発見されることの多い疾患です。この疾患の発症には先天的な脳の発達障害が関与しているということはわかっていますが、その詳細な病態生理については未だに解決されていません。ところで自閉症は、この20年ほどの間にその発症率が驚くほど増加している疾患として注目を集めています。1980年台の統計によれば、自閉症の有病率は世界で大体共通しており、人口1万人に4-5人の割合というデータが得られていました。ところが、ここ数年の統計によれば、自閉症は人口1万人に対し約60人にも上るとのデータもあり、その発症率は10倍かそれ以上に増加していることになります。
私たちは、この驚異的な発症率の増加の裏側には、妊娠している母親がさらされる環境や摂取する物質、そして精神的なストレスといったものの変化が関与しているのではないかと考えました。
自閉症は現在、症候学的な診断法が主になされているため、3歳以前の確定診断は大変難しいのが現状です。しかし一方で、出来るだけ早い時期からの行動療法が患者さんの予後を良くすることがわかっており、なんらかの生物学的な診断方法が確立されることが待たれています。そこで私たちは、自閉症の発症の原因となる脳の変化を観察でき、治療法や診断方法に役立てることができるようなモデル動物の確立を目指しました。
自閉症モデルラット
自閉症は先天的な病気です。胎児の脳の発生期になんらかの障害が起こることよって、脳の神経ネットワーク構築に異常が生じたために、ヒトとしての高次な認知の能力が欠けてしまう病気です。症状が社会性とコミュニケーションの障害という、ヒトならではのものであり、またその発症の原因が単一(例えばひとつの遺伝子の欠失などによる)ではないために、これまで自閉症のモデル動物をつくるのは困難であると言われてきました。
私たちがとった方法は、これまでに疫学的に報告されている「妊婦が摂取すると自閉症を起こさせやすくする物質」を複数選び、それらを妊娠ラットに飲ませた後に生まれた仔ラットに、なにか共通する生化学的、あるいは行動学的な所見がないか、そしてそれがヒトの自閉症の症状と共通しているかどうかを検証する、というものです。
ターゲットにした薬剤は二種類、サリドマイドとバルプロ酸ナトリウムです。1960年代に問題となった薬剤サリドマイドと、抗けいれん剤として使われているバルプロ酸ナトリウム(商標名デパケン、セレニカRなど)を妊娠中に服用した母から生まれた子供たちの中に自閉症を発症する確率がとても高いという事実に目を留めたのです。
最初の方法は、妊娠ラットにこれらの薬剤を投与して、その仔ラットのセロトニンとドパミンの濃度を測定することです。セロトニン、ドパミンといった神経伝達物質は、高次認知機能や感情、衝動性などに関係しているので、自閉症の患者さんの症状に関係があるのではないかということがいわれています。事実、自閉症の患者さんの血液中のセロトニンの濃度が正常の人と比べ、高いことが多い、という報告もあります。
また、自閉症を発症した子供の母親が、これらの薬剤を内服した時期は一致して妊娠のとても早い時期であるということがわかっています。(妊娠20-24日、胎児の心臓が動き始める前後の時期です)そこでこの時期に対応するラットの妊娠時期にそれぞれの薬剤を飲ませ、その後生まれた仔が成体になったときに、脳や血液のセロトニンの濃度を測ってみました。
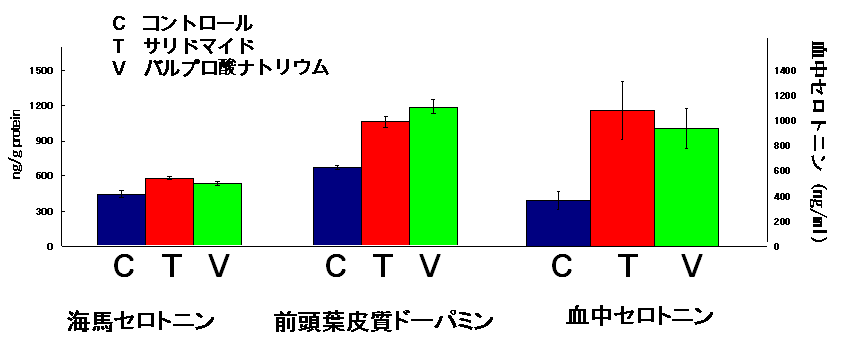 すると、二つの薬剤(サリドマイドとバルプロ酸ナトリウム)は驚くほど一致したセロトニン、ドーパミンの濃度上昇を来たすことがわかりました。発表論文はこちら
すると、二つの薬剤(サリドマイドとバルプロ酸ナトリウム)は驚くほど一致したセロトニン、ドーパミンの濃度上昇を来たすことがわかりました。発表論文はこちら
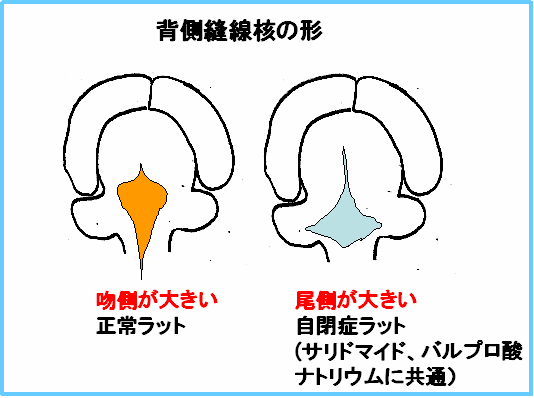 さらに、このラットにおける脳内のセロトニン神経の起始核である縫線核の形を観察したところ、やはり、母ラットがサリドマイド、バルプロ酸ナトリウムのどちらを服用した場合でも、コントロールに比して、その形は後ろにふくらみがずれた変形した縫線核になっていることがわかりました。
さらに、このラットにおける脳内のセロトニン神経の起始核である縫線核の形を観察したところ、やはり、母ラットがサリドマイド、バルプロ酸ナトリウムのどちらを服用した場合でも、コントロールに比して、その形は後ろにふくらみがずれた変形した縫線核になっていることがわかりました。
つまり、私たちの考案した自閉症モデルラットにおいては、全く薬理作用の異なる二つの薬剤、サリドマイドとバルプロ酸ナトリウムが、胎生のある時期に母親の胎盤経由で暴露されることにより、仔のモノアミン神経系に非可逆的な変化、そしてほぼ同じ変化を来たしていることが証明されました。自閉症が多因子疾患であることや、患者さんによってその症状が多様であることも説明できます。
前述したように、近年の自閉症発症率の急激な増加の原因は、この二種類の薬剤と同様の効果を胎生早期の胎児にもたらす様々な物質の増加や環境悪化に伴うものではないかとも考えられます。例えば、PCB、水銀、いわゆる環境ホルモン、アルコール、喫煙、感染症、そして精神的なストレスなどと自閉症発症増加との関連も示唆されています(確実なものはありませんが)。原因がなんであれ、同じ機序で脳の神経ネットワークが障害されること、特に私たちの研究でわかったセロトニン神経系の構築の異常が、自閉症の症状の発現の一部にでも関与しているならば、今後、自閉症の診断や治療、そして予防へと応用していく可能性も開けます。
関連論文
- Kato M, Narita N, Narita M, Okado N.
Serotonin level and learning ability of the pharmacological model rat of autism"
Neuroscience Research 2001 25(1) 165 - Narita N, Kato M, Tazoe M, Miyazaki K, Narita M, and Okado N.
Increased monoamine concentration in the brain and the blood of fetal thalidomide and valproic acid exposed rat ; putative animal models for autism.
Pediatric Research, 2002 52 (4): 576-579 - Miyazaki K, Narita N, Sakuta R, Miyahara T, Naruse H, Okado N, Narita M.
Serum neurotrophin concentrations in autism and mental retardation ; a pilot study.
Brain and Development, 2004, 26: 292-295 - Tashiro Y, Oyabu A, Imura Y, Uchida A, Narita N, Narita M.
Morphological abnormalities of embryonic cranial nerves after in utero exposure to valproic acid: implications for the pathogenesis of autism with multiple developmental anomalies.
International Journal of Developmental Neuroscience, (2010)16:55–61 - Narita M, Oyabu A, Imura Y, Kamada N, Yokoyama M, Tano K, Uchida A, Narita N,
Nonexploratory Movement and Behavioral Alterations in a Thalidomide or Valproic Acid-induced Autism Model Rat.
Neuroscience Res. (2010) 66 : 2-6. - 成田正明、成田奈緒子
サリドマイドと自閉症モデル動物
クリニカルニューロサイエンス, 21巻10号、1208, 2003 - 成田正明、成田奈緒子
発達障害のモデル動物研究の現状と展望
精神保健研究 2004; 50:49-54
慢性疲労症候群とは、原因不明の「疲労感」が6ヶ月以上持続する、という疾患です。大変漠然としていますが、現在この病気で日常生活が困難になっている人の数は数千人にも及ぶのではないかと言われています。この「原因不明の疲労感」の原因となるであろう病因に関しては、様々な説があります。例えばある特殊なウイルスに感染した後に疲労感の蓄積が起こるのではないだろうか、とか患者さんには、共通の免疫不全状態が存在するのではないだろうか、とか疲れを感じる神経系統の異常があるのではないだろうか、などといったものです。
私たちは最近慢性疲労症候群の患者さんで、セロトニントランスポーター多型(上述のSIDSに関与していた遺伝子と同じもの)が偏っていたことを発見しました。発表論文はこちら
また、慢性疲労症候群に関連しているかもしれない新規ペプチドをラット脳から抽出し、「マンセリン」と命名、その機能解析を進めています。
関連論文
- Narita M, Nishigami N, Narita N, Yamaguti K, Okado N, Kuratsune H, Watanabe Y,
Association between Serotonin Transporter Gene Polymorphism and Chronic Fatigue Syndrome.
Biochemical and Biophysical Research Communications, 2003 311:264-266 - Yajima A, Ikeda M, Miyazaki K, Maeshima T, Narita N, Narita M.
Manserin, a novel peptide from secretogranin II in the neuroendocrine system.
NeuroReport, 2004 ; 5:1755-1759 - Yajima A, Narita N, and Narita M.
Recently identified a novel neuropeptide manserin colocalize with the TUNEL-positive cells in the top villi of the rat duodenum.
Journal of peptide science, 2008, 14:773-776 - Kamada N, Tano K, Oyabu A, Imura Y, Narita N, Tashiro Y, Uchida A, Komada Y, Narita M.
Immunohistochemical localization of manserin, a novel neuropeptide derived from secretogranin II, in rat adrenal gland and its upregulation by physical stress.
International Journal of Peptide Research and Therapeutics, (2010) 16:55-61. - Tano K, Oyabu A, Tashiro Y, Kamada N, Narita N, Nasu F, Narita M.
Manserin, a secretogranin II-derived peptide, distributes in the rat endocrine pancreas colocalized with islet-cell specific manner.
Histochemistry and Cell Biology. (2010) 134(1):53-7. - Ohkawara T, Oyabu A, Ida-Eto M, Tashiro Y, Tano K Nasu F, Narita N, Narita M.
Secretogranin II and its derivative peptide, manserin, are differentially localized in Purkinje cells and unipolar brush cells in the rat cerebellum.
International Journal of Peptide Research and Therapeutics (2011) 17(3); 193-199, - Ida-Eto M, Oyabu A, Ohkawara T, Tashiro Y, Narita N, Narita M.
Existence of manserin, a secretogranin II-derived neuropeptide, in the rat inner ear; relevance to modulation of auditory and vestibular system.
Journal of Histochemistry & Cytochemistry, 60(1), 69-75, 2012. - Takeshi Ohkawara, Ph. D.; Takeshi Ohkawara, Ph.D.; Akiko Oyabu; Michiru Ida-Eto; Yasura Tashiro; Naoko Narita; Masaaki Narita
Subtype-specific parafollicular localization of the neuropeptide manserin in the rat thyroid gland
Acta Histochemica, 2012, in press. - 倉恒弘彦、上田素子、成田正明、成田奈緒子、志水彰、渡辺恭良
慢性疲労症候群のリスクファクター-社会ストレスと遺伝的背景
Molecular Medicine 2004; 41(10): 1243-1250
デュシェンヌ型筋ジストロフィー症は、進行性筋ジストロフィーの一種であり、幼少期に、それまで順調に発達してきた児が、次第に筋力低下を起こして気づかれることが多い病気です。走れていた子が次第に走れなくなり、その後徐々に歩けなくなり、立てなくなって車いす生活を余儀なくされます。多くの場合、青年期までに呼吸障害などで亡くなることが多く、知的な障害はない場合が多いです。本人にとっても、また保護者にとってもとても辛い疾患です。
私は1990年ごろより1994年までデュシェンヌ型筋ジストロフィー症の診療に携わっていました。その時に出会った患者さんからいただいた血液、筋肉から解析した遺伝子の欠失パターンから、それまで全く報告されたことのない、新しい発症の機序を発見し、報告しました。それは、患者さんのお母さんのX染色体にある、「ジストロフィン」というタンパクを作る遺伝子の中に、「レトロポゾン」と呼ばれる移動する遺伝子が偶然入り込んでいて、タンパクが作れない異常が起こってしまう、というもので、男の子にはX染色対が一本しかないため、男の子にこの遺伝子が受け継がれるとジストロフィー症が発症してしまう、というものです。
このお母さんの遺伝子で発見されたL1 配列は、ヒトゲノム中に104~105コピー存在する分散型反復配列の一種であり、レトロポゾンとして自己増幅能力を保有します。このL1配列がお母さんの生殖細胞内において、ジストロフィン遺伝子内に挿入されたためにエクソンのスキッピングを生じ、デュシャンヌ型筋ジストロフィーを発症したと考えられました。
これは、デュシェンヌ型筋ジストロフィー症としては、世界で初めての症例です。このようなL1配列の挿入変異が疾患発症の直接原因となる例は、それまで血友病第VIII因子遺伝子に挿入された例が報告されただけでした。
関連論文
- Narita N, Nishio H, Kitoh Y, Ishikawa Y, Ishikawa-Y, Minami R, Nakamura H, Matsuo M.
Insertion of a 5' truncated L1 element into the 3' end of exon 44 of the dystrophin gene resulted in skipping of the exon during splicing in a case of Duchenne muscular dystrophy.
Journal of Clinical Investigation 1993 91: 1862-1867. - 成田奈緒子、西尾久英、木藤嘉彦、萩原容子、中村肇、松尾雅文、石川悠加、石川幸辰、南良二
レトロポゾンL1配列の挿入により生じたデュシェンヌ型筋ジストロフィー
日本先天異常学会雑誌 1994 19:33-38. - 松尾雅文、成田奈緒子、西尾久英
レトロポゾンL1の挿入による遺伝子病.
細胞工学 1992; 11: 686-690.